백신&세포유전자치료제 GMP센터
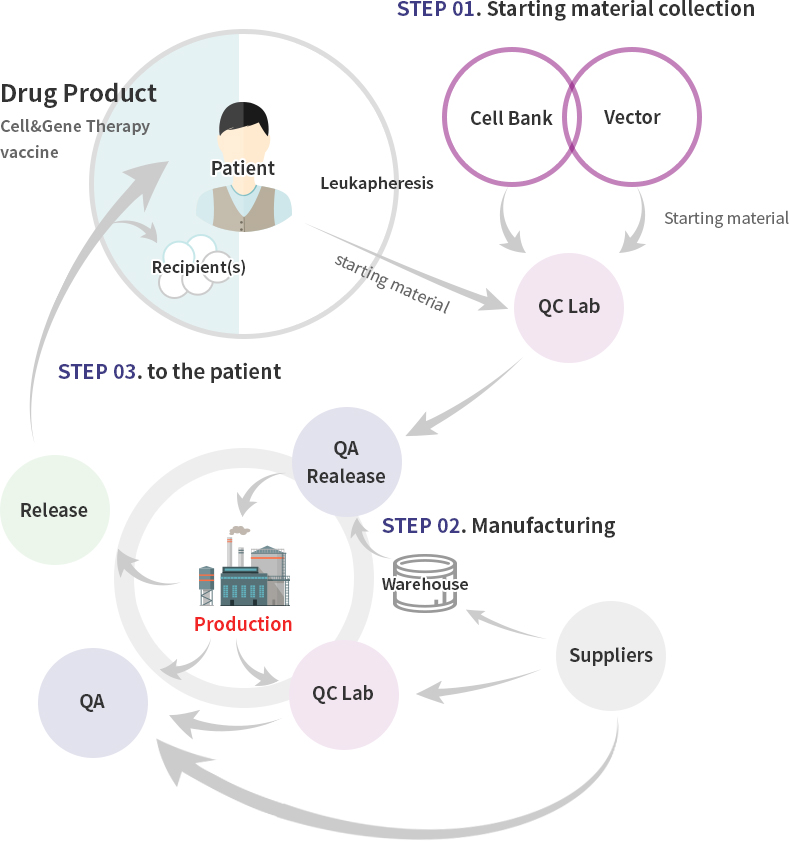
셀리드의 백신&세포유전자치료제 GMP센터는 임상 및 상업용 의약품생산을 위해 GMP기준에 맞게 설계되었습니다.
CeliVax™ Pipeline은 식품의약품안전처(MFDS) 및 PIC/S, 첨단바이오의약품(ATMP) 가이드라인에 적합하도록 높은 수준의 품질시스템(QMS)을 통해 생산됩니다.
셀리드의 백신&세포유전자치료제 GMP센터는 2가지로 분류됩니다.
CeliVax™ Pipeline은 식품의약품안전처(MFDS) 및 PIC/S, 첨단바이오의약품(ATMP) 가이드라인에 적합하도록 높은 수준의 품질시스템(QMS)을 통해 생산됩니다.
셀리드의 백신&세포유전자치료제 GMP센터는 2가지로 분류됩니다.
- 280평(925m2/9956ft2)
- 임상 및 상업용 완제의약품 생산 시설
- BSL2 Vector 이용가능 시설
- 무균공정실(Grade B)
- Closed System 적용
- 충진 및 포장
- 완제의약품 보관(LN2 Tank)
- 자체 QC 시험실
- 187평(618m2/6652ft2)
- 임상 및 상업용 백신 생산 시설
- 임상 및 상업용 원료의약품 생산 시설
- BSL2 Vector 생산 시설
- 무균공정실(Grade B)
- 충진 및 포장
- 원료의약품 보관
- 자체 QC 시험실
GMP Manufacturing-infra